Immunologia molecolare e biologia dei linfomi
Introduzione
Immunologia molecolare e biologia dei linfomi è un programma di ricerca IFOM coordinato da Stefano Casola e dedicato allo studio dei meccanismi che garantiscono il corretto funzionamento dei linfociti B e di come il loro malfunzionamento provoca lo sviluppo di tumori chiamati linfomi.
I linfomi raggruppano diversi tipi di tumori del sangue, che colpiscono le cellule del sistema immunitario chiamate linfociti.
I linfomi colpiscono prevalentemente i linfociti B che sono deputati alla produzione di anticorpi per proteggerci dall'attacco di agenti estranei quali virus e batteri.
Un linfoma nasce a cause di difetti nel normale funzionamento di un linfocita B che viene reclutato in una risposta immunitaria.
Per esempio, nel corso di un'infezione causata da un virus o un batterio, i linfociti B riconoscono come estraneo l'intruso e rispondono all'invasione proliferando rapidamente e rilasciando anticorpi che legano l'agente infettivo neutralizzandolo.
Per potenziare l'efficacia di anticorpi diretti contro virus e batteri, i linfociti B reclutati in una risposta immune, accumulano rapidamente mutazioni nei geni delle immunoglobuline. Attraverso un processo di selezione naturale, il linfocita che produce l'anticorpo "mutato" migliore per capacità di riconoscere il patogeno, vince su tutti gli altri e contribuisce a formare un'armata di cellule B memoria, che garantiranno all'organismo di rispondere con piu' solerzia e efficacia ad un incontro successivo con lo stesso virus/batterio.
Proprio l'intensa proliferazione cellulare e il processo mutazionale a cui sono sottoposti i linfociti B durante una normale risposta immune possono trasformarsi nel primo nemico di queste cellule, contribuendo all'acquisizione di alterazioni genetiche capaci di provocare il linfoma.
Una serie di meccanismi molecolari che salvaguardano l'integrità genomica impediscono però giornalmente a decine di migliaia di linfociti B di accumulare mutazioni nocive in geni diversi da quelli delle immunoglobuline. La perdita di tali controlli contribuisce allo sviluppo dei linfomi.
Al sistema immunitario e ai suoi meccanismi di azione, IFOM dedica il programma di Immunologia molecolare e biologia dei linfomi.
Sotto la guida di Stefano Casola, il team di ricercatori impegnato in questa ricerca studia i linfociti B, allo scopo di:
- comprendere le basi genetiche che controllano la proliferazione, la sopravvivenza e la specializzazione funzionale di queste cellule;
- scoprire come, una volta alterati, alcuni di questi geni contribuiscono allo sviluppo di linfomi;
- identificare meccanismi e individuare geni che controllano l'accrescimento dei linfomi allo scopo di individuare e personalizzare i bersagli di terapia e combattere la resistenza a terapie standard.
L'Ambito Biologico
Il programma di ricerca IFOM dedicato all'Immunologia molecolare e biologia dei linfomi studia la fisiologia e la patologia dei linfociti B con lo scopo di comprendere: 1) i normali meccanismi di funzionamento di queste cellule durante una risposta immunitaria, e 2) le cause che determinano l'insorgenza di neoplasie maligne derivate da tali cellule, chiamati linfomi.
I linfociti B sono generati nel midollo osseo durante tutta la vita. Appena generati, vengono immessi nel sangue per raggiungere stazioni operative specializzate - i linfonodi o la milza - oppure per pattugliare i diversi organi e distretti corporei.
Sono armati di uno speciale dispositivo presente sulla superficie della cellula, il recettore immunoglobulinico (anche detto anticorpo), grazie al quale catturano costituenti di virus o batteri oppure agenti ambientali quali pollini. Il riconoscimento attraverso l'immunoglobulina di membrana di componenti di virus e batteri scatena una risposta da parte dei linfociti B che culmina con il rilascio nel sangue di grosse quantità dello stesso anticorpo. Tale azione garantisce una rapida neutralizzazione dell'agente patogeno attraverso una cooperazione con altre cellule del sistema immunitario.
Sono quindi i linfociti B, uno dei principali attori del sistema immunitario.
Se non riconoscono un antigene attraverso l'immunoglobulina di membrana, i linfociti B completano il loro ciclo vitale morendo dopo diverse settimane di vita. La perdita giornaliera di linfociti B è compensata da un continuo rilascio di nuove cellule dal midollo osseo.
Se però il recettore immunoglobulinico intercetta un antigene estraneo al l'organismo, allora cambia tutto. L'evento stimola nel linfocita B l'accensione di segnali biochimici che si propagano dalla superficie verso l'interno della cellula. Tali segnali inducono i linfociti B a dividersi ripetutamente prima di differenziare in cellule secernenti grandi quantità di immunoglobuline.
Mentre proliferano, i linfociti B "migliorano" la loro capacità di riconoscere e neutralizzare l'agente esterno attraverso il recettore immunoglobulinico.
Migliorare significa una cosa sola: introdurre mutazioni nei geni che servono a produrre le immunoglobuline e selezionare quelle cellule che hanno prodotto le mutazioni più vantaggiose, ovvero quelle che garantiscono agli anticorpi di riconoscere meglio l'antigene. Cicli ripetuti di proliferazione e mutazioni rappresentano una miscela esplosiva, se non ben dosata.
Il macchinario molecolare che, causando mutazioni nel DNA, opera il miglioramento genetico delle immunoglobuline anche se altamente specifico, può, infatti, per errore raramente colpire altri geni quali quelli che promuovono la crescita e la sopravvivenza cellulare.
Alterare la funzione di questi geni facilita lo sviluppo di forme maligne di tumori dei linfociti B chiamati linfomi.
Quindi, frequentemente, i linfomi originano da cellule B intente a proliferare e perfezionarsi in risposta ad un'infezione virale/batterica o al riconoscimento di altri antigeni ambientali.
La ricerca delle cause genetiche dei linfomi e'stato accelerato da recenti conquiste tecnologiche relative al sequenziamento del genoma umano. Da tali studi e da investigazioni su modelli tumorali preclinici, siamo oggi in grado di avere una mappa fedele delle alterazioni genetiche piu'comunemente associate alla comparsa di linfomi Hodgkin e Non-Hodgkin che colpiscono i linfociti B.
Ancora molto, però, rimane da scoprire su di essi. Quali alterazioni genetiche sono necessarie per iniziare il processo tumorale che porta ai linfomi? E quali, invece, sono essenziali per garantire la crescita incontrollata delle cellule B maligne? Quali causano la disseminazione della malattia al di fuori dei linfonodi? Studiare il meccanismo di azione dei geni comunemente alterati in linfomi, e'fondamentale per comprendere da un lato il loro contributo al normale funzionamento di un linfocita B e dall'altro i meccanismi attraverso i quali essi provocano la comparsa di linfomi.
Il recente sviluppo di farmaci capaci di neutralizzare l'azione di alcuni dei geni piu'comunemente mutati nei linfomi B sta aprendo una nuova era basata su terapie molecolari personalizzate. Per fare ciò c'è bisogno di sviluppare nuovi test genetici capaci di rivelare la combinazione di mutazioni genetiche specifiche per ogni tumore. La genomica diagnostica aiuterà anche a stabilire i meccanismi responsabili della resistenza dei linfomi alle attuali terapie, e ad individuare trattamenti di seconda linea in pazienti che non hanno risposta alle prime cure.
Gli obiettivi del programma
Per comprendere le cause dell’insorgenza dei linfomi, il primo obiettivo dell'unità diretta da Casola è studiare gli eventi molecolari che controllano la normale attività di un linfocita B.
Questo significa, innanzitutto, indagare come il recettore immunoglobulinico controlla la sopravvivenza, la proliferazione e la specializzazione di queste cellule.
Significa anche capire in che modo i segnali originati dall'immunoglobulina di membrana sono integrati in un circuito molecolare più; complesso che garantisce la maturazione funzionale dei linfociti B.
Intimamente collegati ai primi obiettivi, vi è un forte interesse ad identificare le alterazioni genetiche e dei processi molecolari che ne derivano, che sono responsabili della trasformazione maligna di un linfocita B.
Per Casola e per il gruppo di scienziati che coordina, lo scopo finale di tutti gli studi è trovare nuovi bersagli per elaborare terapie mirate e individuare tratti molecolari caratteristici che possano essere utilizzati per riconoscere le diverse forme e sottoforme di linfoma e per guidare le scelte terapeutiche di prima e seconda battuta.
Gli approcci
Il team diretto da Casola impiega approcci genetici, di biologia cellulare e molecolare nelle proprie ricerche.
Particolarmente significativo è l'utilizzo di una tecnica che permette di modulare la funzione di geni di interesse specificamente in quei linfociti B che sono bersaglio dei linfomi, lasciando il resto del sistema immunitario (e dell'organismo) inalterato. Capire in che modo "spegnere" o rendere continuamente "acceso" un gene, altera la funzione del linfocita B durante una risposta immune ed eventualmente ne causa la trasformazione maligna rappresenta il principale focus delle investigazioni dell'unità.
Fondamentale per il programma, è avere uno stretto collegamento con la clinica. Le informazioni in modelli preclinici diventano utili per il paziente solo quando vengono confermate in analisi eseguite su tessuti tumorali umani. L'unità di ricerca coordinata da Casola per questo collabora assiduamente con specialisti clinici e applica, fra le altre, le più avanzate tecnologie per l'analisi genomica di campioni tumorali provenienti da pazienti.
Impatto su diagnosi, prevenzione o trattamento dei tumori
I linfomi sono uno dei più frequenti tumori che colpiscono le cellule del sangue. Non si tratta di una singola malattia tumorale, ma di tante diverse condizioni all'interno della stessa patologia. Oggi, infatti, si contano una trentina di forme differenti di questo tumore.
I progressi nello studio del genoma delle cellule maligne stanno rivelando che, pure all'interno di questi sottogruppi considerati omogenei per caratteristiche e decorso clinico, esiste una notevole eterogeneità dal punto di vista molecolare, che si traduce in variazioni negli esiti della malattia, come anche in una diversa risposta dei pazienti ai trattamenti farmacologici. Tutto questo complica la cura di molte forme tumorali
Nella lotta ai linfomi - come quelli ad altri tumori ? diventa, quindi, fondamentale la stratificazione dei pazienti sulla base delle alterazioni genetiche accumulate da ciascun tumore, sapendo allo stesso tempo, che ognuno di essi è, a sua volta, costituito da possibili sotto-entità tumorali diverse. Ricostruire con fedeltà la complessità genetica di ogni linfoma rappresenta uno degli strumenti migliori che abbiamo per identificare la terapia più efficace per curare questa malattia.
Il programma IFOM coordinato da Stefano Casola Immunologia molecolare e biologia dei linfomi, dedicato allo studio dei meccanismi che controllano la funzione dei linfociti B e che causano la loro trasformazione maligna ha le potenzialità di contribuire in maniera diretta a trovare soluzioni a questi problemi, offrendo nuovi potenziali bersagli per la terapia e informazioni molecolari utili ai clinici per classificare la malattia, prevederne l'andamento e la risposta ai trattamenti.
2016.05.31 01
Photogallery
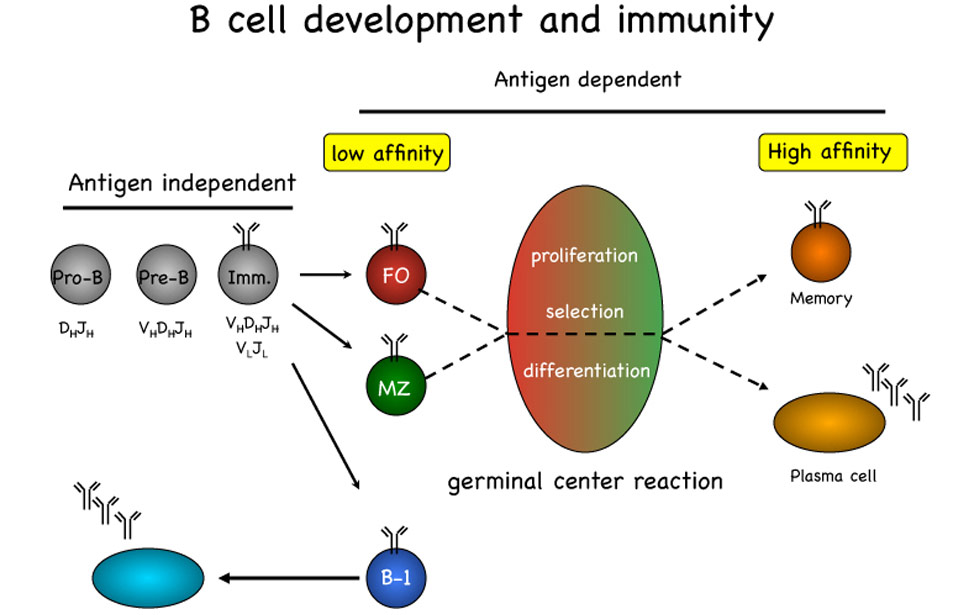 B-cell-development
B-cell-development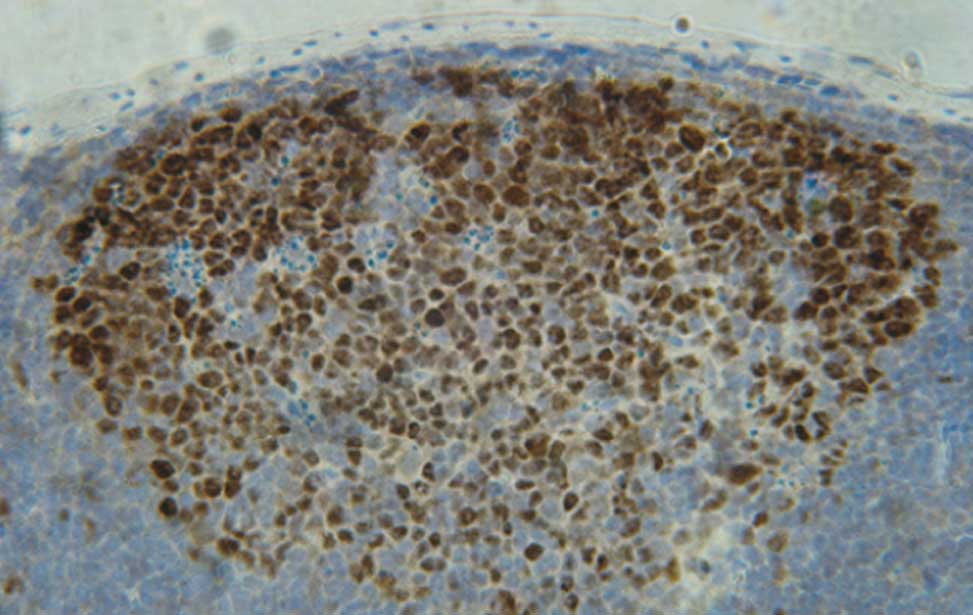 The germinal reaction
The germinal reaction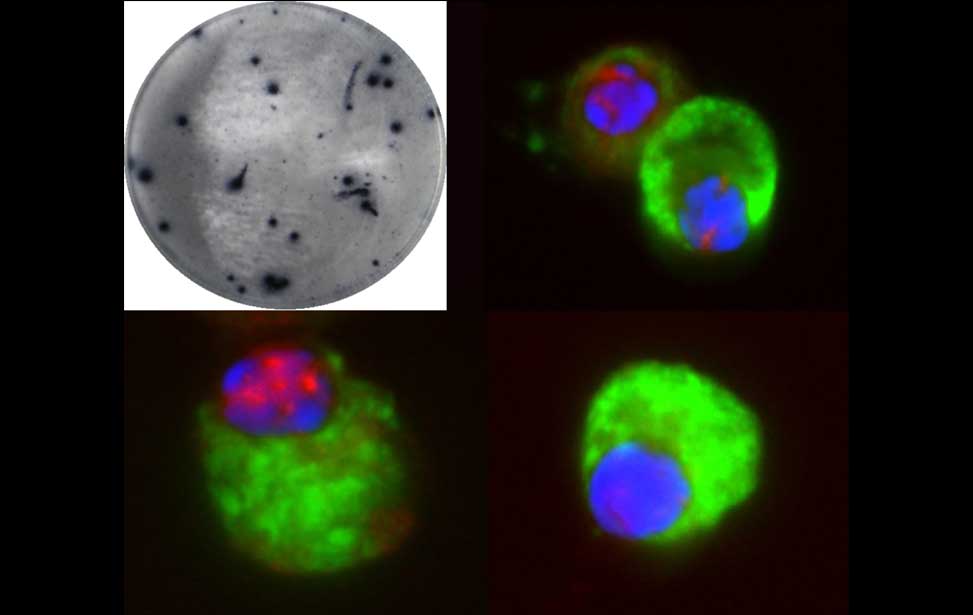 Antibody producing cells
Antibody producing cells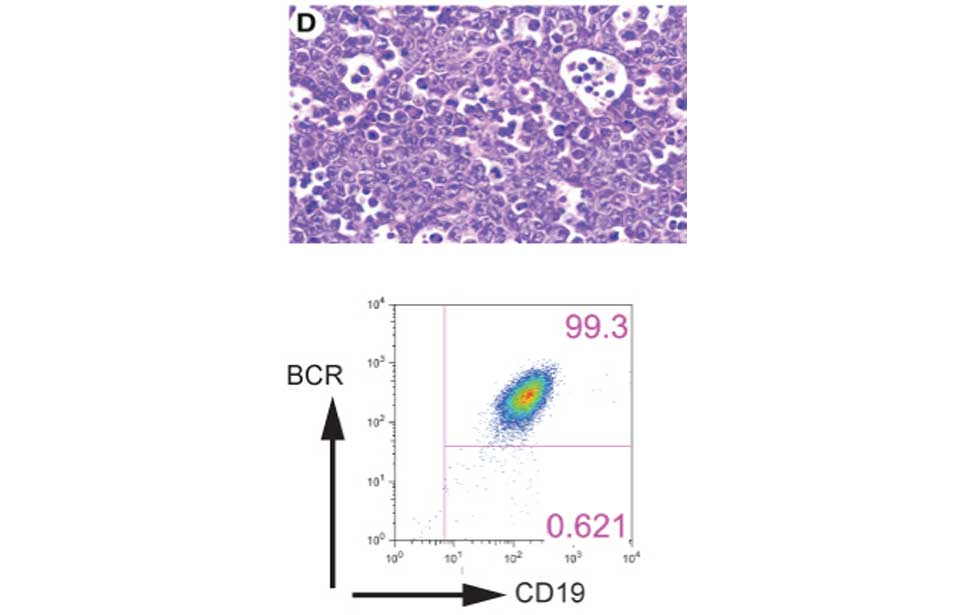 Burkitt lymphoma
Burkitt lymphoma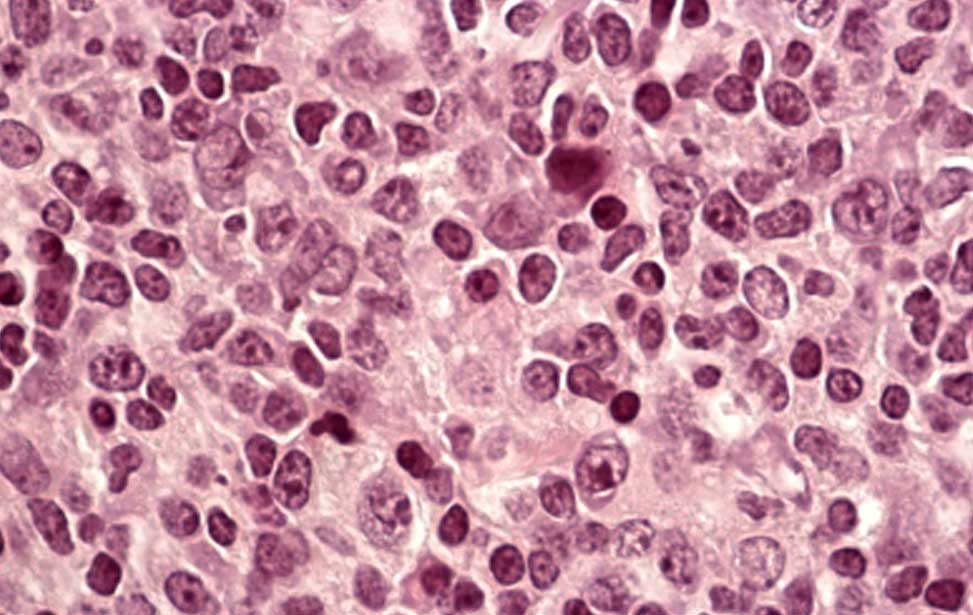 Diffuse Large B-cell lymphoma
Diffuse Large B-cell lymphoma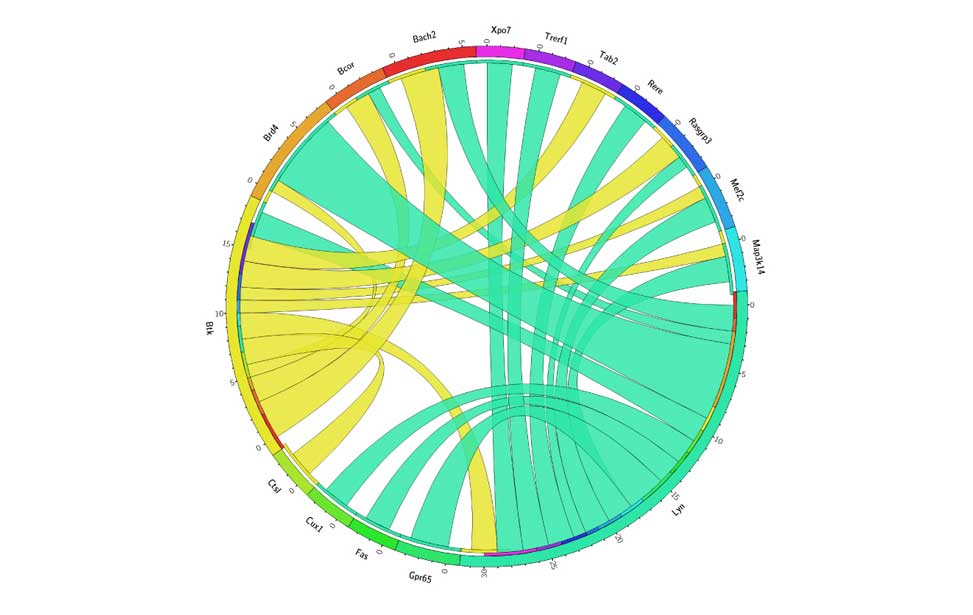 Epigenetics of B-lymphocytes and lymphomas
Epigenetics of B-lymphocytes and lymphomas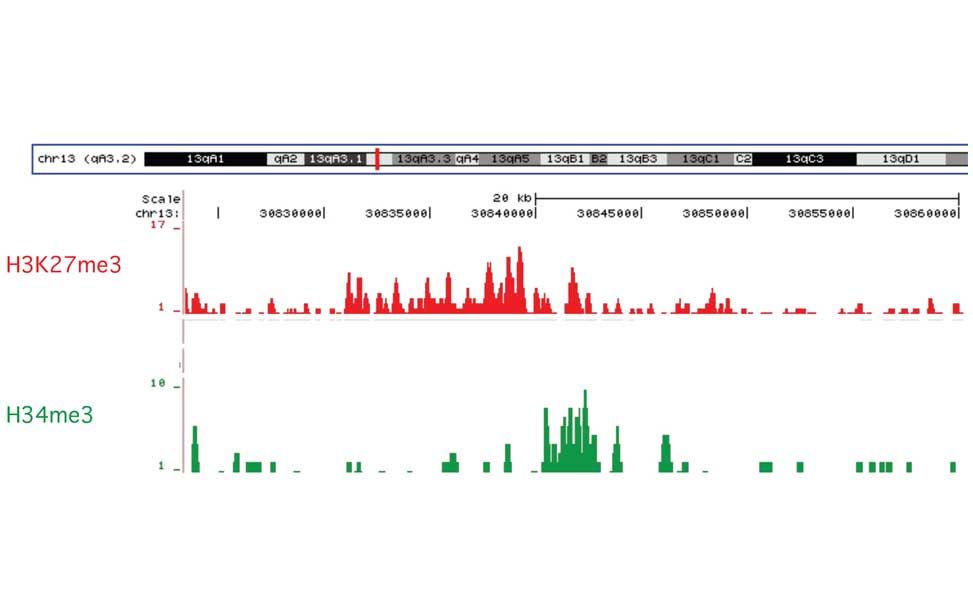 Screening for cancer mutations
Screening for cancer mutations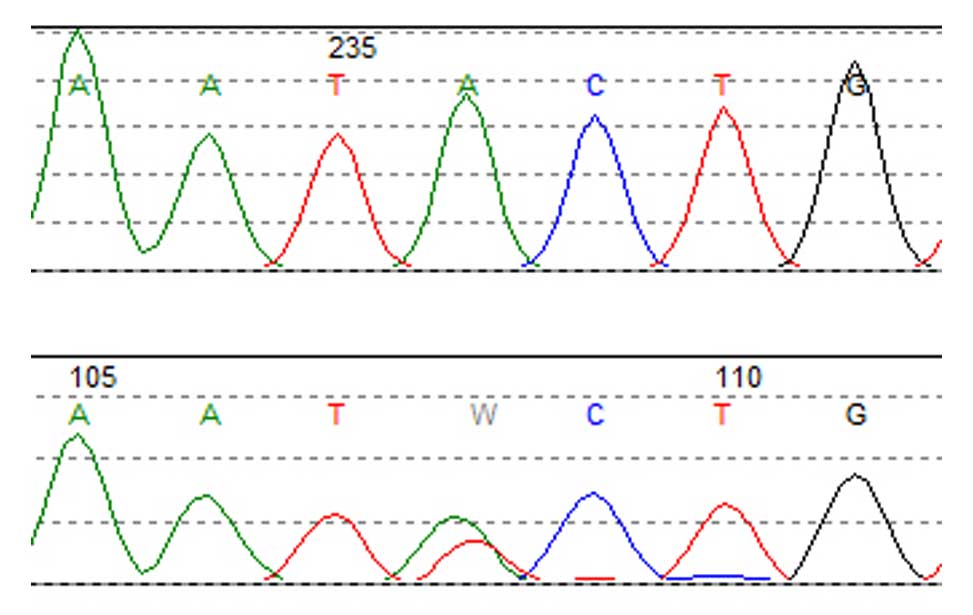 Genetics of Diffuse Large B-cell lymphomas
Genetics of Diffuse Large B-cell lymphomas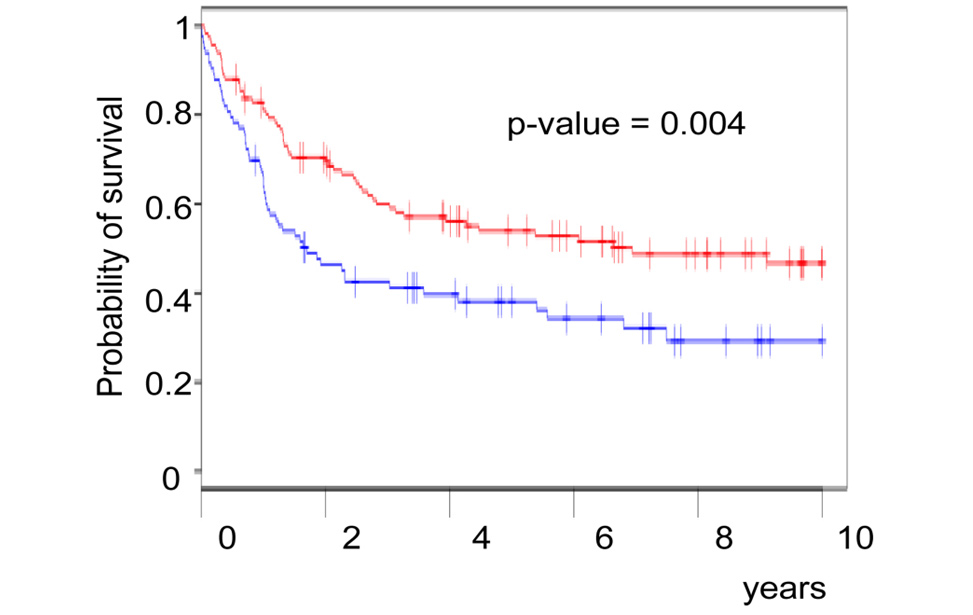 Novel prognostic factors in Diffuse Large B-cell lymphomas
Novel prognostic factors in Diffuse Large B-cell lymphomas 