Programma Genome Diagnostics
Background e stato dell'arte
L'avvento del sequenziamento massivo e parallelo del DNA ha rivoluzionato il campo della ricerca biomedica, garantendo una decifrazione rapida ed economica della sequenza del genoma umano. Ciò ha portato a una drastica accelerazione nell'identificazione delle alterazioni genetiche responsabili di diverse malattie congenite e acquisite. In particolare, sfruttando la tecnologia del sequenziamento di nuova generazione (NGS), i progetti di sequenziamento del genoma su larga scala, sia nazionali che internazionali, hanno compiuto progressi sostanziali nella ricostruzione dello spettro di alterazioni genetiche ricorrenti presenti nelle forme sporadiche ed ereditarie di cancro.
Il continuo accumulo di informazioni sul sequenziamento del genoma di tumori primari in tutto il mondo ha visto un parallelo incremento della bioinformatica del genoma. Lo sviluppo (e il continuo miglioramento) di algoritmi informatici dedicati consente oggi un'analisi sempre più rapida dei dati genomici, garantendo l'indagine concomitante di molteplici aspetti della biologia del cancro. Tali informazioni hanno già portato a una sostanziale rivisitazione dei concetti fondamentali alla base dell'iniziazione, della progressione e delle metastasi del cancro.
Gli studi di sequenziamento del genoma/esoma su larga scala hanno anche accelerato l'identificazione di nuovi fattori genetici che conferiscono una predisposizione ereditaria a sviluppare il cancro. Queste conoscenze sono in rapida espansione e si prevede che nei prossimi 10 anni rivoluzioneranno il sistema sanitario in molti Paesi del mondo. La tecnologia NGS offre già l'opportunità di eseguire screening individuali, familiari o di popolazione a costi contenuti per un elenco crescente di geni di predisposizione al cancro. Queste informazioni miglioreranno sostanzialmente l'identificazione degli individui a rischio di sviluppare un tumore, fornendo così un supporto fondamentale nel processo decisionale delle opzioni di riduzione del rischio o di sorveglianza.
Infine, l'implementazione della tecnologia NGS applicata ai genomi del cancro ha rappresentato un punto di svolta per le decisioni terapeutiche. Infatti, la decifrazione dello spettro di mutazioni associate ai singoli tumori primari offre l'opportunità di progettare trattamenti oncologici personalizzati. La NGS consente inoltre di stimare con precisione l'eterogeneità delle cellule tumorali nei singoli tumori. Quest'ultima informazione è importante per spiegare le basi della resistenza tumorale primaria e acquisita alle terapie attuali. La rivelazione della complessità genetica dei singoli tumori attraverso lo screening genetico basato sulla NGS dovrebbe fornire all'oncologo la possibilità di progettare trattamenti combinatori su misura per il paziente, mirati a colpire contemporaneamente più sottopopolazioni tumorali indipendenti che compongono il tumore.
I nostri obiettivi
I ricercatori dell'IFOM sono impegnati a studiare i fattori genetici che predispongono al cancro e i meccanismi che promuovono lo sviluppo del cancro e le metastasi, guardando al "problema cancro" da una prospettiva genetica, molecolare, cellulare e organismica. In IFOM, gli studi su modelli tumorali preclinici sono abbinati a indagini su tumori primari umani e su famiglie predisposte al cancro, in stretta collaborazione con oncologi, patologi, chirurghi e consulenti genetici di centri nazionali e internazionali.
Siamo particolarmente interessati a tradurre i risultati dei modelli preclinici di cancro e del sequenziamento del genoma del cancro nella progettazione di nuovi test genetici per lo screening. Intendiamo inoltre ampliare il portafoglio di varianti genetiche da sottoporre a screening per stabilire un aumento del rischio ereditario di sviluppare particolari forme di cancro. La fase di validazione sarà seguita dall'implementazione di questi test nelle cliniche, dove si potranno offrire trattamenti personalizzati ai portatori di mutazioni specifiche.
Inoltre, i ricercatori dell'IFOM sono attivamente impegnati in indagini sulla biologia dei cromosomi e del genoma per capire come diversi tipi di alterazioni genetiche che si osservano di frequente nelle cellule tumorali contribuiscano alla loro predisposizione, allo sviluppo e all'evoluzione metastatica.
Infine, una comprensione più approfondita delle basi genetiche responsabili della predisposizione, dell'inizio, dello sviluppo e della progressione del cancro è combinata in IFOM con analisi bioinformatiche di database di genomi umani (del cancro) pubblicamente accessibili, per progettare infine nuovi test genetici e metodologie incentrate sul genoma che aiutino ad anticipare la diagnosi del cancro e a guidarne il trattamento.
Il GDP (Programma di diagnostica del genoma, Genome Diagnostic Program) dell'IFOM
Questo programma fonde l'ambiente scientifico unico dell'IFOM con le tecnologie genomiche avanzate, per sviluppare test genetici e metodologie per la prevenzione, la diagnosi e la prognosi del cancro e per guidare il trattamento personalizzato. Nell'ambito del GDP, le attività di ricerca sono incanalate in due aree principali di indagine:
1) Diagnosi del cancro e trattamento delle malattie oncologiche.
Le collaborazioni attive con patologi, oncologi e chirurghi consentono ai ricercatori IFOM di condurre un'analisi sistematica delle alterazioni geniche candidate associate a:
- a. Sottotipi di cancro specifici.
- b. Resistenza/risposta alle terapie standard.
- c. Distribuzione subclonale delle cellule tumorali.
- d. Efficacia di nuove terapie molecolari e/o immunoterapiche.
Grazie alla collaborazione con gli oncologi, il panorama mutazionale dei singoli tumori viene associato all'istotipo tumorale e alla documentazione clinica del paziente, comprese le terapie presenti e passate. L'abbinamento dei dati genetici (ad esempio, lo spettro di mutazioni geniche) e clinici dovrebbe aiutare i medici a stratificare al meglio i pazienti oncologici che possono beneficiare di specifici regimi terapeutici, prevenendo al contempo gli effetti collaterali tossici per quei pazienti il cui tumore ha un profilo genetico "sbagliato".
Viene inoltre compiuto un notevole sforzo per ricostruire la composizione clonale dei tumori primari. In questo contesto, il GDP sta lavorando attivamente per ottimizzare le metodologie che consentono il profilo molecolare di migliaia di singole cellule tumorali provenienti dallo stesso tumore, per ottenere una mappa genetica rappresentativa dei sottogruppi di cellule tumorali che compongono la massa tumorale. Queste informazioni forniranno il quadro molecolare per progettare trattamenti combo mirati allo stesso tempo alle singole sottopopolazioni tumorali che compongono la massa tumorale.
2) Identificazione dei fattori genetici predisponenti al cancro.
Negli ultimi dieci anni, i ricercatori IFOM hanno stabilito collaborazioni con epidemiologi, genetisti e biologi molecolari di istituzioni nazionali e internazionali e stanno collaborando attivamente a progetti portati avanti da grandi consorzi e finalizzati a:
- a. Identificazione di nuovi geni e varianti predisponenti al cancro.
- b. Classificazione delle varianti di significato incerto (VUS).
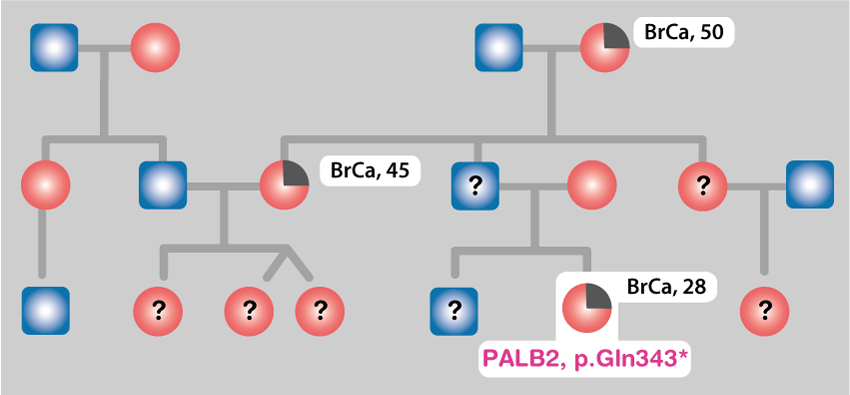
Le mutazioni nei geni BRCA1, BRCA2 e PALB2 , da un lato, e nei geni del sistema di riparazione del mismatch, dall'altro, conferiscono un rischio elevato di sviluppare il cancro al seno e al colon-retto, rispettivamente. Si prevede l'esistenza di altri geni e varianti rare associati al rischio di sviluppare queste malattie. La loro identificazione aumenterà la possibilità di individuare nelle famiglie e nella popolazione generale gli individui a rischio per queste (ed eventualmente altre) malattie.
Molte delle varianti individuate nei geni BRCA1, BRCA2, PALB2 e in altri geni del cancro al seno sono associate al rischio di malattia; tuttavia, alcune sono attualmente non classificate e chiamate VUS (varianti di incerta rilevanza). Stiamo portando avanti studi basati sulla popolazione e sulla famiglia e analisi funzionali volte a classificare molte di queste varianti, chiarendo quali sono fattori di rischio e quali sono neutrali. Ciò consentirà di fornire stime più precise del rischio in una frazione più ampia di individui provenienti da famiglie e dalla popolazione generale.
Risorse chiave mobilitate
Per raggiungere questi obiettivi, il GDP si basa su una solida infrastruttura tecnologica incentrata sulla tecnologia NGS all'avanguardia, coordinata dall'unità genomica dell'IFOM. Inoltre, cruciali per il successo del programma sono i bioinformatici formati che si occupano dell'analisi, dell'interpretazione e dell'archiviazione dell'enorme quantità di dati derivanti dal sequenziamento di migliaia di esomi e genomi.
Il rapido trasferimento delle conoscenze dal banco di prova al letto del malato sarà garantito dalla stretta collaborazione dei ricercatori del GDP con l'Unità di Test Genetici (GT) di Cogentech, che negli ultimi 10 anni ha servito gli ospedali locali eseguendo test genetici diagnostici accreditati dal Sistema Sanitario Nazionale per i geni predisponenti al cancro al seno e al colon. I nuovi test genetici sviluppati dal GDP saranno messi a disposizione dei medici attraverso l'Unità GT di Cogentech, che contribuirà all'ottimizzazione delle procedure per fornire i test ai medici e ai consulenti genetici in tempi e costi contenuti.
Impatto previsto
Il GDP è un programma basato sulla ricerca che sfrutta le conoscenze derivanti da indagini avanzate sul genoma del cancro e da studi di base su modelli preclinici di cancro, su pazienti affetti da cancro e su famiglie a rischio di cancro, per migliorare la diagnosi e il trattamento del cancro e per identificare nuovi geni predisponenti al tumore. Prevediamo di sviluppare test genetici a costi contenuti per migliorare la prevenzione del cancro e la sua diagnosi precoce e per personalizzare il trattamento del cancro. Il consolidamento delle collaborazioni tra i ricercatori IFOM e gli oncologi, i patologi, i chirurghi e i consulenti genetici è fondamentale per la rapida convalida dei test genetici di nuova concezione in ambito clinico. La ricerca condotta nell'ambito dell'IGDRP dovrebbe aiutare un ampio spettro di pazienti oncologici e di individui a rischio di sviluppare la malattia. Riteniamo che una parte più ampia di questi individui possa beneficiare di opzioni di riduzione del rischio, di strategie di sorveglianza migliorate per la diagnosi precoce della malattia e di trattamenti clinici migliori.