News e Comunicati stampa
BRCA1 e BRCA2: famosi ma misteriosi? Non più, una ricerca italiana svela la loro funzione
2017.09.11
Una ricerca condotta dall’IFOM di Milano spiega il ruolo dei due geni nella diagnosi dei principali tumori femminili e maschili. Lo studio, pubblicato sulla prestigiosa rivista scientifica Molecular Cell, punta inoltre all’individuazione di nuove molecole da sperimentare nella lotta al cancro a mammella e ovaio.
 In questa figura si può apprezzare una forca di replicazione ricavata da cellule in cui il gene BRCA2 è stato eliminato. Il DNA nell’incrocio centrale dove si incontrano tre fibre si apre per essere duplicato nelle due eliche figlie. Si può notare però come in prossimità dell’incrocio una delle eliche duplicate subisca una perdita di materiale che la fa apparire come una zona più sottile rispetto alle altre. Si tratta di un vero e proprio "buco" che sottidende la mancaza di replicazione accompagnata da degradazione del filamento. Questo processo non avviene in cellule normali.
In questa figura si può apprezzare una forca di replicazione ricavata da cellule in cui il gene BRCA2 è stato eliminato. Il DNA nell’incrocio centrale dove si incontrano tre fibre si apre per essere duplicato nelle due eliche figlie. Si può notare però come in prossimità dell’incrocio una delle eliche duplicate subisca una perdita di materiale che la fa apparire come una zona più sottile rispetto alle altre. Si tratta di un vero e proprio "buco" che sottidende la mancaza di replicazione accompagnata da degradazione del filamento. Questo processo non avviene in cellule normali.I geni BRCA1 e BRCA2 sono stati scoperti negli anni Novanta e da subito hanno assunto un’importanza fondamentale nella diagnosi dei tumori soprattutto della mammella e dell’ovaio, e nella nostra capacità di comprendere quello che succede quando una cellula normale si trasforma in una cellula tumorale. All’inizio sono stati studiati per il loro l’impatto, quando mutati, nel predisporre all’insorgenza dei principali tumori femminili. Tuttavia, i recenti progressi delle tecniche di sequenziamento del DNA hanno messo in evidenza l’enorme importanza dei geni BRCA anche per tumori maschili come quello della prostata e in malattie ancora difficilmente curabili come il cancro del pancreas e del polmone.
Nonostante l’importanza dei geni BRCA fosse chiara, non si conosceva però il meccanismo del loro funzionamento e per molto tempo la ricerca si è focalizzata solo su dati che associavano mutazioni in varie parti dei geni BRCA e la presunta funzione di tali geni. Da poco si è riusciti a comprendere a fondo la funzione dei geni BRCA, in particolare del gene BRCA2, grazie alla ricerca effettuata nel laboratorio di IFOM diretto da Vincenzo Costanzo. La ricerca è stata sostenuta da finanziamenti di AIRC, ERC e Fondazione Armenise-Harvard, e i risultati sono pubblicati in questi giorni sulla prestigiosa rivista americana Molecular Cell, che li ha messi in risalto con un commento editoriale.
Per capire come si sia arrivati a questa scoperta bisogna partire da un’osservazione fatta nel 2010 dallo stesso Costanzo che ha messo in evidenza per la prima volta come una proteina molto studiata, chiamata RAD51, avesse un ruolo fondamentale nella protezione del DNA da parte di enzimi che normalmente lo degradano come la proteina Mre11. Questa osservazione ha rivelato come il DNA appena sintetizzato in cellule umane e di altri organismi modello quali gli anfibi sia sottoposto a continua degradazione da parte di Mre11 per motivi complessi che rimangono tutt’ora poco conosciuti.
La ricerca ora pubblicata ha evidenziato, a distanza di sette anni, come BRCA2 sia il regolatore principale dell’attività di protezione di RAD51 nei confronti di Mre11. "BRCA2 - spiega Costanzo - promuove la formazione di una guaina di protezione formata da tante molecole di RAD51 che si dispongono a spirale intorno al filamento di DNA. Questo previene l’attacco di enzimi degradativi come Mre11, che in assenza di tale guaina distruggono il DNA appena sintetizzato".
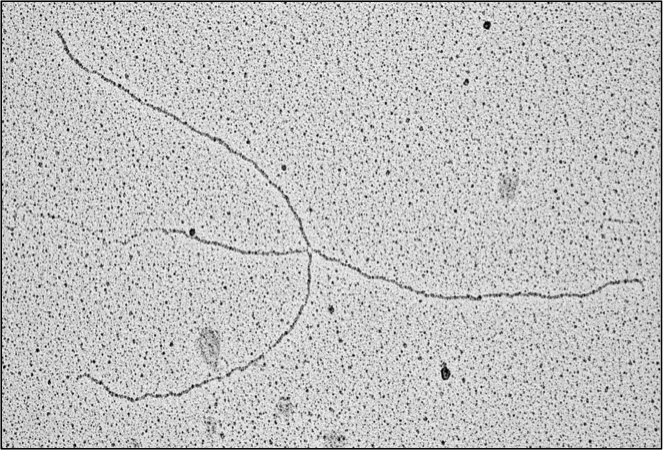 In questa seconda imaggine il DNA subisce un ulteriore trasformazione, in cui il buco iniziale viene trasformato in un incrocio a quattro fibre, chiamato anche forca invertita. L’estremità a sinistra di una delle fibre viene degradata ulteriormente fungendo da punto di entrata per gli enzimi di degradazione del DNA come Mre11. Il ruolo di BRCA2 è quello di formare una guaina protettiva intorno a questa estremità fatta di polimeri di RAD51 prevenendone la degradazione.
In questa seconda imaggine il DNA subisce un ulteriore trasformazione, in cui il buco iniziale viene trasformato in un incrocio a quattro fibre, chiamato anche forca invertita. L’estremità a sinistra di una delle fibre viene degradata ulteriormente fungendo da punto di entrata per gli enzimi di degradazione del DNA come Mre11. Il ruolo di BRCA2 è quello di formare una guaina protettiva intorno a questa estremità fatta di polimeri di RAD51 prevenendone la degradazione.In assenza del gene BRCA2, cosa che avviene di frequente nei tumori umani, Mre11 degrada liberamente il DNA, creando delle discontinuità che portano a lesioni della doppia elica. Tali lesioni sono riparate in modo non corretto da altri geni, che inseriscono così una serie di errori nella sequenza del DNA. L’accumulo di questi errori predispone alla formazione dei tumori.
Per queste ricerche il team IFOM diretto da Costanzo si è servito di potenti microscopi elettronici che hanno permesso di evidenziare per la prima volta al mondo la struttura del DNA in assenza di BRCA2: le immagini hanno rivelato la presenza di numerose discontinuità, ossia di veri e propri buchi nella doppia elica che predispongono alla formazione di forche di replicazione invertite, poi attaccate da Mre11 in assenza di BRCA2. Queste strutture sono formate da due filamenti singoli di DNA che si appaiano tra loro a formare un incrocio che viene prontamente riconosciuto e distrutto da Mre11. "Questi studi - aggiunge Costanzo - hanno quindi permesso anche di comprendere che l’inibizione di Mre11 potrebbe prevenire l’insorgenza di queste lesioni e della loro successiva degenerazione che predispone ai tumori. Non solo: i risultati ci consentono anche di capire come funzionano i farmaci che si stanno sperimentando nel tumore della mammella e ovaio, i cosiddetti inibitori di PARP che sfruttano la debolezza intrinseca delle cellule tumorali che non hanno BRCA, prevenendone la riparazione e quindi inducendo la morte delle cellule che accumulano tali lesioni".
Vincenzo Costanzo, che ha fondato il suo laboratorio di Metabolismo del DNA all’IFOM nel 2013 dopo aver vinto il grant Career Development Award della Fondazione Armenise-Harvard, ha lavorato per oltre 10 anni negli Stati Uniti e in Gran Bretagna prima di tornare in Italia.
Lo sforzo di Costanzo nei prossimi anni sarà di identificare nuove molecole che possano uccidere i tumori dipendenti dai geni BRCA basandosi sulle nuove conoscenze e servendosi della nuova drug discovery unit di IFOM. A tal scopo si cercherà di comprendere il legame tra mancata riparazione del DNA e cambiamenti del metabolismo cellulare che permette la crescita dei tumori con lo scopo di individuare nuove molecole o suggerire farmaci già disponibili per la terapia del cancro.
Questa ricerca non sarebbe stata possibile senza il contributo fondamentale di: Associazione Italiana per la Ricerca sul Cancro (AIRC), ERC e Fondazione Armenise-Harvard.
L’ARTICOLO
- TESTATA: Molecular Cell
- DATA DI PUBBLICAZIONE: 27 luglio 2017
- DOI: 10.1016/j.molcel.2017.07.001
- TITOLO: Smarcal1-Mediated Fork Reversal Triggers Mre11-Dependent Degradation of Nascent DNA in the Absence of Brca2 and Stable Rad51 Nucleofilaments.
- AUTORI: Kolinjivadi AM, Sannino V, De Antoni A, Zadorozhny K, Kilkenny M, Técher H, Baldi G, Shen R, Ciccia A, Pellegrini L, Krejci L, Costanzo V.