Science: ricerca tutta italiana scopre come la cellula "rottama" un recettore implicato nei principali tumori
Milano, 12 maggio 2017
Il processo di duplicazione cellulare è controllato anche dagli stimoli che arrivano alla cellula dall’ambiente esterno attraverso l’attivazione di alcuni recettori posti sulla sua superficie, che funzionano come interruttori di proliferazione. Eliminare questi interruttori dopo che hanno svolto la loro funzione fisiologica è fondamentale: l’eccessiva proliferazione è infatti tipica delle cellule tumorali.
Un gruppo di ricercatori guidati da Pier Paolo di Fiore e Sara Sigismund dell’IFOM e dell’Università Statale di Milano, in collaborazione con il Centro di Imaging Sperimentale diretto dal professor Carlo Tacchetti, dell’IRCCS Ospedale San Raffaele, ha svelato uno dei meccanismi con cui la cellula riassorbe uno di questi recettori, chiamato EGFR, e lo elimina. La scoperta, pubblicata oggi sulla prestigiosa rivista Science e possibile grazie al sostegno di AIRC, apre nuove prospettive di ricerca nella battaglia contro diversi tumori - come quelli di cervello, colon, polmoni e seno - in cui il recettore EGFR è presente in modo anomalo.
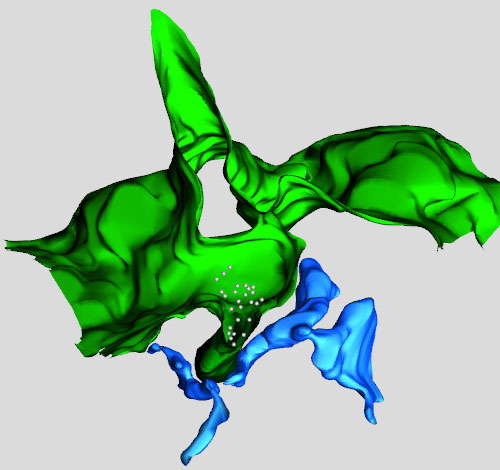 Ricostruzione 3D medianteTomografia Elettronica (ET) di una zona della superficie cellulare (in verde) che si ripiega verso l'interno della cellula intrappolando i recettori (i pallini bianchi). Il reticolo endoplasmatico (in blu) ha preso contatto con la superficie cellulare introflessa e la 'tira', facendola staccare e trascinandola all'interno della cellula. I recettori vengo in questo modo rimossi dalla superficie cellulare.
Ricostruzione 3D medianteTomografia Elettronica (ET) di una zona della superficie cellulare (in verde) che si ripiega verso l'interno della cellula intrappolando i recettori (i pallini bianchi). Il reticolo endoplasmatico (in blu) ha preso contatto con la superficie cellulare introflessa e la 'tira', facendola staccare e trascinandola all'interno della cellula. I recettori vengo in questo modo rimossi dalla superficie cellulare. Le cellule comunicano con l'ambiente esterno attraverso la membrana cellulare, che delimita il loro spazio vitale ed è in grado di ricevere e trasmettere una miriade di segnali chimici, che guidano processi cellulari importanti. Questo scambio continuo avviene grazie a delle specie di antenne, i recettori, posti sulla membrana. Uno di questi, chiamato EGFR, è coinvolto in particolare nella ricezione di uno dei segnali di proliferazione. Una volta ricevuto il segnale però il recettore EGFR deve essere rimosso dalla superficie, viceversa la cellula continuerebbe a dividersi senza controllo. Tutto ciò è possibile grazie al processo di endocitosi, con cui i recettori vengono letteralmente inglobati all’interno della cellula per poi essere destinati alla distruzione. Disordini e malfunzionamenti nel meccanismo di endocitosi possono contribuire notevolmente alla formazione dei tumori e alla loro proliferazione, proprio perché lasciano accessibili degli interruttori che se eccessivamente stimolati spingono la cellula a comportarsi in modo anomalo. Ecco perché comprenderne il meccanismo è così importante.
"La comprensione dei meccanismi di funzionamento della cellula - precisa Pier Paolo Di Fiore, direttore del programma di ricerca IFOM La logistica cellulare nel cancro e Professore all’Università degli Studi di Milano - è fondamentale per poter poi studiare come si alterano questi meccanismi in varie malattie, tra le quali quella di principale interesse per noi è il cancro. Tuttavia non ci può essere azione senza conoscenza. Lo sviluppo di nuove strategie per combattere il cancro passa attraverso lo studio, nei laboratori molecolari, dell'estrema complessità della cellula: un lavoro lungo e meticoloso ma assolutamente indispensabile."
Il team di ricerca guidato da Pier Paolo Di Fiore ha dedicato gli ultimi 20 anni a studiare l’endocitosi, rivelandone una complessità superiore a quella precedentemente riconosciuta nella comunità scientifica. Con lo studio pubblicato oggi su Science – possibile solo combinando tecnologie genomiche, proteomiche e di microscopia elettronica ad alta risoluzione - viene descritta, per la prima volta, una nuova modalità di assorbimento per endocitosi.
"Abbiamo identificato un gruppo di molecole specializzate - spiega Sara Sigismund di IFOM, corrispondente della ricerca insieme al Professor Di Fiore -. Alcune di queste si trovano nel reticolo endoplasmatico, un organello che forma una vera e propria rete all’interno della cellula. Quando c’è bisogno di rimuovere e distruggere l’EGFR, il reticolo si estende fino ad arrivare alla superficie cellulare dove si trova il recettore e lo 'tira' all’interno della cellula. In situazioni anomale, in cui questo gruppo di molecole non si comporta correttamente, il reticolo non riesce più a raggiungere la superficie cellulare per riassorbire il recettore, che non viene più distrutto e continua a produrre il segnale di duplicazione."
"Per osservare questo meccanismo abbiamo sviluppato nuovi approcci di microscopia ad alta definizione. Questo sviluppo è stato reso possibile grazie alle tecnologie all’avanguardia disponibili presso il San Raffaele, e all’elevata esperienza del team di ricercatori che vi lavora, in grado di utilizzarle in modo innovativo", spiega Carlo Tacchetti del Centro di Imaging Sperimentale dell’Ospedale San Raffaele di Milano.
Il prossimo passo sarà comprendere come il meccanismo endocitico fisiologico appena descritto possa essere alterato nelle cellule del cancro. "Se il suo ruolo fosse confermato - spiega Di Fiore - potrebbe spiegare perché in alcuni tumori l’attività del recettore dell’EGF è aumentata, aprendo la strada a ulteriori ricerche per identificare nuovi bersagli terapeutici con cui colpire i tumori e interferire con la loro crescita."

Lo studio è stato possibile grazie ai finanziamenti dell’Associazione Italiana per la Ricerca sul Cancro, dell’organizzazione internazionale Worldwide Cancer Reasearch (UK), del Ministero dell’Istruzione, dell’Università e della Ricerca, del Ministero della Salute, della Fondazione Monzino e della Fondazione Italiana per la Ricerca sul Cancro.
L’ARTICOLO
- TESTATA: Science
- DATA DI PUBBLICAZIONE: 12 maggio 2017
- Vol. 356, Issue 6338, pp. 617-624
DOI: 10.1126/science.aah6152 - TITOLO: Reticulon3-dependent ER-PM contact sites control EGFR non-clathrin endocytosis
- AUTORI: Giusi Caldieri*1, Elisa Barbieri*1, Gilda Nappo*1, Andrea Raimondi*4, Massimo Bonora6, Alexia Conte1, Lisette G.G.C. Verhoef1, Stefano Confalonieri1, Maria Grazia Malabarba1,2, Fabrizio Bianchi3, Alessandro Cuomo3, Tiziana Bonaldi3, Emanuele Martini1, Davide Mazza3, Paolo Pinton6, Carlo Tacchetti4,5, Simona Polo1,2, Pier Paolo Di Fiore1,2,3# e Sara Sigismund1#
1. IFOM, Fondazione Istituto FIRC di Oncologia Molecolare, Milano, Italia.
2. Dipartimento di Oncologia ed Emato-Oncologia (DiPO), Università degli Studi di Milano, Milano, Italia.
3. Istituto Europeo di Oncologia, Milano, Italia.
4. Centro di Imaging Sperimentale, IRCCS Ospedale San Raffaele, Milano, Italia.
5. Dipartimento di Medicina Sperimentale, Università degli Studi di Genova, Genova, Italia.
6. Dipartimento di Morfologia, Chirurgia e Medicina Sperimentale, Università degli Studi di Ferrara, Ferrara, Italia.
- *, # Questi autori hanno contributo allo stesso modo